Geschiedenis over de ZvH
De ZvH is vernoemd naar George Huntington, een Amerikaanse arts die de ziekte beschreef in 1872. Zijn beschrijving was gebaseerd op observaties van aangedane Huntington families in het dorpje East Hamptom op het eiland Long Island, vlakbij New York (USA), waar dokter Huntington leefde en werkte. De ZvH was in het verleden bekend als Huntington’s chorea en Saint Vitus’s dans.
Symptomen & ziekte progressie
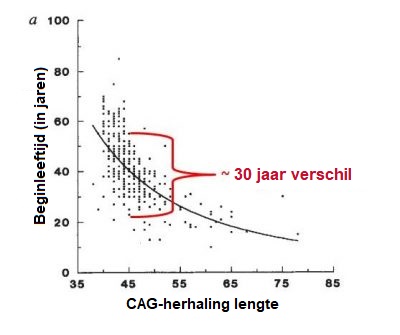
De ZvH is een zeldzame ziekte die in Europa bij 5 tot 10 op de 100,000 inwoners voorkomt. Een vergelijkbare prevalentie is gevonden in landen waar personen van Europese afkomst wonen, zoals in de USA. De ZvH komt minder vaak voor in Aziatische en Afrikaanse landen, waar de prevalentie wordt geschat op 1 op de 100,000 inwoners. Mannen en vrouwen hebben evenveel kans om het verlengde Huntington gen via hun ouders te erven en de ziekte te ontwikkelen. De ZvH wordt gekenmerkt door een combinatie van stoornissen in motoriek (bewegingen), gedrag (bijvoorbeeld stemming) en cognitie (bijvoorbeeld begrip) maar er kunnen ook andere symptomen worden gerapporteerd. De symptomen kunnen per persoon erg uiteenlopen. Ze kunnen verschillen in heftigheid, leeftijd waarop ze ontstaan en de snelheid waarmee ze ontwikkelen. Deze verschillen komen ook voor bij personen uit dezelfde familie. Een persoon kan bijvoorbeeld een duidelijke bewegingsstoornis hebben, met daarnaast lichte psychiatrische symptomen en cognitieve achteruitgang, terwijl een ander persoon misschien jaren heel veel last heeft van depressie en angsten voordat er afwijkende bewegingen ontstaan. Het begin van de ZvH wordt beschreven als ‘verraderlijk’ omdat het moeilijk is om te bepalen wanneer de ziekte nu echt begint. De meeste personen die dragers zijn van de ZvH, ontwikkelen symptomen op middelbare leeftijd – dat is tussen hun 35ste en 55ste levensjaar. Ongeveer 10% van de mensen ontwikkelt klachten voor hun 20ste levensjaar (de zogenaamde juveniele vorm van HD) en 10% na hun 55ste levensjaar. Over het algemeen ontwikkelt de ziekte zich zeer geleidelijk, daarom wordt de ziekte soms pas jaren later gediagnosticeerd. De gemiddelde ziekteduur is 15 tot 20 jaar vanaf de diagnose, maar dit varieert sterk tussen individuen en hangt ook af van de kwaliteit van zorg die een patiënt krijgt. De factoren die de beginleeftijd van de ziekte bepalen zijn complex en tevens het onderwerp van lopende onderzoeken. Wanneer er gekeken wordt naar grote groepen Huntington patiënten, vinden onderzoekers een correlatie tussen het aantal trinucleotide herhalingen en de beginleeftijd van symptomen (zie het onderstaande figuur). Dit betekent dat, over het algemeen, hoe groter het aantal CAG-herhalingen, des te eerder de beginleeftijd van symptomen. Echter, zoals weergegeven in het onderstaande figuur, is de variabiliteit in de beginleeftijd maximaal 30 jaar voor elke CAG-herhaling. Dit is waarschijnlijk te wijten aan het effect van andere genen dan HTT (de zogeheten genetische modifier) en omgevingsfactoren zoals levensstijl en dieet. Als we dit allemaal samen nemen, is het moeilijk om de precieze beginleeftijd nauwkeurig te voorspellen voor elk persoon die drager is van het verlengde Huntington gen. Met behulp van een classificatie ontwikkeld door neuroloog en Huntington specialist Ira Shoulson van de Georgetown Universiteit in de USA, wordt het beloop van de ZvH onderverdeeld in vijf fasen: Wanneer de ZvH vroeg in het leven begint (dat wil zeggen voor het 20ste levensjaar) zijn de onwillekeurige bewegingen (chorea) minder duidelijk aanwezig dan symptomen van traagheid van bewegingen (bradykinesie) en stijfheid (dystonie). Vroege kenmerken van juveniele Huntington zijn duidelijke gedragsveranderingen, leer- en spraakproblemen en een schoolachterstand. Epileptische aanvallen worden af en toe gemeld, overigens komen deze vaker voor bij jonge patiënten. In de meeste gevallen gaan de mensen met juveniele Huntington sneller achteruit dan patiënten met de volwassenen vorm. Wanneer de ziekte op latere leeftijd begint, zijn de chorea vaak sterker aanwezig, terwijl de traagheid en stijfheid minder duidelijk aanwezig zijn. In deze gevallen is het moeilijker om de familiegeschiedenis te achterhalen. De ouders van de patiënt zijn namelijk meestal al overleden, soms zelfs voordat zij zelf symptomen van de ziekte hebben vertoond. Mensen met de ZvH sterven niet direct aan de gevolgen van de ziekte maar eerder door medische problemen die kunnen ontstaan als gevolg van een verzwakte gezondheid. Zoals longontsteking (dit veroorzaakt een derde van de sterfgevallen bij Huntington patiënten), verstikking, hartfalen, hoofdletsel als gevolg van vallen en ondervoeding. Het zelfmoord risico is aanzienlijk toegenomen en leidt bij 7% van alle patiënten tot sterfgevallen.Hoe vaak komt de ziekte van Huntington voor?
Wat zijn symptomen van de ZvH?
De meest voorkomende psychiatrische symptomen van de ZvH zijn apathie, angst, depressie, prikkelbaarheid, woede-uitbarstingen, impulsiviteit, obsessief-compulsief gedrag, slaapstoornissen en sociale terugtrekking. Manie en schizofrenie met wanen (ongewone gedachten) en hallucinaties (zien, horen of voelen van dingen die niet echt bestaan) worden minder frequent gerapporteerd. Aangedane individuen kunnen, vooral in de vroege fase van de ziekte, suïcidale gedachten ervaren. De meeste Huntington patiënten en hun verzorgers ervaren de gedragssymptomen als meer verontrustend dan de motorische- of cognitieve beperkingen die veroorzaakt worden door de ziekte.
De ZvH wordt gekenmerkt door toenemende problemen met begrijpen, redeneren, oordelen en geheugen. De cognitieve symptomen zijn minder snel denken en moeilijkheden met concentreren, organiseren, plannen en beslissingen nemen en vragen beantwoorden, evenals problemen met het korte termijngeheugen, het opnemen van nieuwe informatie en het oplossen van problemen.
Een aantal andere symptomen die kunnen voorkomen tijdens het beloop van de ZvH zijn gewichtsverlies, verliest van eetlust, verminderd zelfvertrouwen, een verminderd libido en incontinentie (zowel urine als fecale).Wanneer verschijnen symptomen van de ZvH?
Wat bepaalt de beginleeftijd van de symptomen?
Wat zijn de verschillende fases van progressie van de ZvH?
Verschillen de symptomen van de juveniele vorm van de ziekte
van Huntington met de volwassenen vorm?
Wat zijn de symptomen wanneer de ziekte laat in het leven start?
Doodsoorzaken
Diagnose & behandeling
De ZvH wordt gediagnosticeerd met behulp van zowel klinische evaluaties als een genetische test. De klinische diagnose is gebaseerd op de medische en familiaire geschiedenis van een persoon evenals op standaard onderzoeken die gebruik maken van klinische evaluatieschalen om de frequentie en ernst van de ZvH symptomen te bepalen. De resultaten van de klinische diagnose worden meestal bevestigd door de genetische screening voor de HTT verlenging (bekend als diagnostische of bevestigende genetische test). Als een persoon geen symptomen heeft, maar wel risico heeft op het krijgen van de ziekte, zal een asymptomatische genetische test (bekend als voorspellende genetische test) bepalen of zij wel of niet het verlengde gen dragen.Hoe wordt de ZvH gediagnosticeerd?
De klinische evaluatie hulpmiddelen die gebruikt worden om de diagnose ZvH te stellen en de aspecten van de presentatie ervan te meten, zijn niet hetzelfde in alle klinieken in alle landen. Het meest gebruikte instrument is echter de Unified Huntington’s Disease Rating Scale (UHDRS), welke wordt onderverdeeld in motoriek, gedrag, cognitie en functionele subonderdelen. Aanvullend wordt vaak de Problem Behaviours Assessment for Huntington’s Disease (PBA) gebruikt om de ernst en frequentie van gedragsproblematiek (zoals depressieve stemming, apathie en prikkelbaarheid), terwijl verscheidene tests, zoals de Mini-Mental State Examination (MMSE) en de Mattis Dementia Rating Scale, worden gebruikt ter aanvulling van het subonderdeel van de UHDRS die cognitieve problemen meet.Welke klinische beoordelingshulpmiddelen worden gebruikt om de
diagnose ZvH te stellen?
Leven met de kennis dat u een risicodrager bent van de ZvH kan tot veel onrust en zorgen leiden. Het kan zijn dat u zeker wilt weten of u gendrager bent. In dat geval worden professionele begeleiding van een klinische geneticus en psychologische steun erg aanbevolen, omdat zij u de mogelijkheid bieden uw opties te bekijken en uw zorgen te bespreken. Over het algemeen wordt een voorspellende genetische test niet aanbevolen voor iemand die jonger is dan 18 jaar – de leeftijd waarop men ervan uitgaat dat een persoon volwassen genoeg is om te gaan met het feit dat hij het afwijkende gen draagt. In uitzonderlijke gevallen is het echter toegestaan om de bevestigende genetische test uit te voeren bij kinderen – als zij bijvoorbeeld tekenen van juveniele Huntington vertonen – of bij zwangere vrouwen die jonger zijn dan 18 jaar. Als u besluit om genetisch getest te worden, zal er een bloedmonster worden afgenomen uit een ader in uw arm, vervolgens zal uw DNA uit het bloed worden verkregen in een laboratorium. Afhankelijk van de lokale service, zal u de uitslag binnen twee tot acht weken krijgen. Richtlijnen voor de procedure voor een voorspellende genetische test zijn bijgewerkt door de werkgroep Genetische testen en counseling in 2012.Wat is de procedure voor een voorspellende genetische test?
De genetische test bepaalt het aantal CAG-herhalingen van het HTT gen. De test vertelt u of u drager bent van de Huntington verlenging, maar kan u niet vertellen wanneer de ziekte zich zal gaan ontwikkelen, hoe snel het beloop zal zijn of welke symptomen uw mogelijk zal ontwikkelen. De genetische test voor de ZvH wordt als bijna 100% betrouwbaar beschouwd. De resultaten van de DNA analyse worden gewoonlijk dubbel gecheckt door twee verschillende bloedmonsters te gebruiken. Aanvullend kan het bloed van een ouder van de aangedane persoon (of als dat niet mogelijk is van een ander familielid) ook getest worden ter bevestiging van de eerste diagnose.Wat zoekt de genetische test?
Ja. Dit is mogelijk door een moderne diagnostische techniek te gebruiken, de zogeheten pre-implantatie genetische diagnostiek (PGD) – ook wel bekend als het onderzoeken van een embryo – dit wordt gecombineerd met in-vitrofertilisatie (IVF) en omvat het screenen van embryo’s voorafgaand aan hun plaatsing in de baarmoeder. De techniek zorgt ervoor dat alleen embryo’s met normale kopieën van het gen worden teruggeplaatst. Vandaar dat het zelfs mogelijk is voor een stel, als een van hen de Huntington-verlenging draagt, middels PGD een kind te verwekken dat geen gen drager is van het afwijkende HTT gen – ongeacht of de moeder of vader drager is van het gen. PGD is echter in sommige landen, vanwege embryo beschermingswetten, niet toegestaan en het is ook belangrijk om te vermelden dat de kansen om zwanger te worden na PGD/IVF kleiner zijn dan met “natuurlijke” bevruchting. In sommige landen is het mogelijk om ongeboren foetussen, die natuurlijk zijn verwerkt, te testen en om te kiezen voor abortus zodra de genetische status van het ongeboren kindje bekend is.Is het voor een gendrager mogelijk om een kind te verwekken dat de
aanleg voor de ziekte niet heeft?
Prenatale (voor de geboorte) diagnostiek wordt alleen verstrekt indien de aanvrager kan aantonen dat er wordt voldaan aan medische en wettelijke criteria, die landspecifiek zijn. Er zijn 2 klassieke methoden voor prenatale diagnostiek. De eerste is de vruchtwaterpunctie (ook wel vruchtwatertest genoemd), hierbij wordt, meestal na de 14de week van de zwangerschap, middels een naald die via de buikwand van de moeder wordt ingebracht, vruchtwater verkregen dat foetuscellen bevat. De tweede is een vlokkentest waarbij een monster van de chorionvilli (placentaweefsel) wordt verzameled en welke eerder kan worden uitgevoerd – tussen de 10de en 13de week van de zwangerschap. Dit brengt echter meer risico met zich mee voor de foetus.Kan ik mijn ongeboren kind laten testen?
Er zijn momenteel geen therapieën die de onderliggende oorzaak van de ZvH effectief kunnen behandelen. Echter heeft fundamenteel en klinisch onderzoek van de afgelopen jaren onze kennis over de ZvH erg laten toenemen en zijn er momenteel veel onderzoeken gaande die de pathogenese van de ziekte onderzoeken om zo medicijnen te vinden die het begin van de ziekte kunnen uitstellen of het beloop kunnen vertragen. Er zijn al behandelingen die de symptomen van de ziekte verlichten en daardoor de kwaliteit van leven verbeteren. Deze behandelingen worden onderverdeeld in farmacologische (met medicijnen) en niet-farmacologische (zonder medicijnen) behandelingen.Zijn er behandelingen voor de ZvH?
Chorea, bradykinesie, prikkelbaarheid, apathie, depressie, angst en slaapproblemen worden nog steeds als de meest beperkende symptomen van de ZvH gerapporteerd. Er zijn een aantal opties om deze symptomen te behandelen met behulp van medicatie. Medicijnen kunnen echter bijwerkingen geven en sommige werken elkaar tegen. Daarnaast kan dezelfde medicatie andere effecten hebben op iedere persoon. Behandeling moet daarom per persoon worden aangepast door een ervaren Huntington specialist, op basis van de symptomen van een patiënt en zijn of haar reactie op het betreffende medicijn.Welke medicijnen worden gebruikt om de symptomen van de ziekte te behandelen?
Behandelingen zonderen medicijnen (zoals psychotherapie, fysiotherapie, ademhalings-, spraak-, bezigheids- en cognitieve therapieën) kunnen de psychosociale en fysieke symptomen van de ZvH verbeteren. Verbeteringen na deze therapieën zijn bijvoorbeeld gemeld voor stemming, bewegingscontrole, spraak, balans, slikken en het lopen. Het is bekend dat sporten zowel de fysieke als mentale gezondheid en het algehele welzijn verbetert, daarnaast is het aangetoond dat sporten de symptomen van depressie verlicht. Er is toenemend bewijs dat dit mogelijk ook de progressie van de bewegingsbeperkingen bij de ZvH vertraagt. Sommige fysiotherapeutische behandelingen hebben bijvoorbeeld verbeteringen laten zien op het gebied van bewegingssymptomen, houding en de balans. De fysiotherapie werkgroep van het EHDN heeft een document met richtlijnen voor fysiotherapeuten die werken met Huntington patiënten gepubliceerd.Hoe kunnen niet-farmacologische behandelingen helpen?
De voordelen van een speciaal dieet voor mensen met de ZvH dat rijk is aan vitaminen, co-enzymen en andere componenten is veel besproken maar niet bewezen. Echter is gewichtsverlies, vooral in de latere fases van de ziekte, een probleem voor sommige Huntington patiënten, het is daarom belangrijk om voor een gezond dieet te zorgen tijdens het beloop van de ziekte. Tijdens latere fasen kan een hoog caloriehoudend dieet nodig zijn. Een verwijzing naar een diëtiste kan nuttig zijn.Kan een speciaal dieet de symptomen van de ZvH verlichten?
Overerving & wat veroorzaakt de ZvH?
De ZvH wordt veroorzaakt door een verandering (een verlenging) in het gen (HTT) dat een bepaald eiwit maakt dat we huntingtine noemen. Als resultaat van deze verlenging wordt het gen vertaald in een aangepaste vorm van het eiwit, dat resulteert in het uitvallen en afsterven van zenuwcellen (neuronen) in specifieke brein gebieden. De exacte mechanismen van de ziekte zijn veelzijdig en erg complex, evenals de verschillende functies van het Huntington eiwit. Onderzoekers werken eraan om een beter begrip te krijgen van de onderliggende mechanismen, die de ziekte van Huntington veroorzaken, om zo therapieën te ontwikkelen die de ziekte kunnen verminderen.Wat veroorzaakt de ZvH?
In 1993 ontdekten onderzoekers de mutatie die de ZvH veroorzaakt. Het HTT gen ligt op chromosoom 4 en maakt een eiwit dat huntingtine heet. Het gen bevat een reeks van drie nucleotiden (de basisonderdelen van DNA), cytosine-adenine-guanine (CAG), dat een aantal keer wordt herhaald. Deze zogeheten trinucleotide herhaling (ook wel CAG-herhaling genoemd) kan variëren in lengte. Indien een persoon 40 of meer CAG-herhalingen in één kopie van het HTT gen heeft, zal hij/zij de ziekte van Huntington op een bepaald moment in het leven ontwikkelen – dit is op middelbare leeftijd. Vanwege het feit dat de verlenging die de ZvH veroorzaakt aanwezig is in alle lichaamscellen vanaf de bevruchting en omdat het doorgegeven kan worden aan volgende generaties, is de ZvH een erfelijke ziekte.Wat is de onderliggende oorzaak van de ZvH?
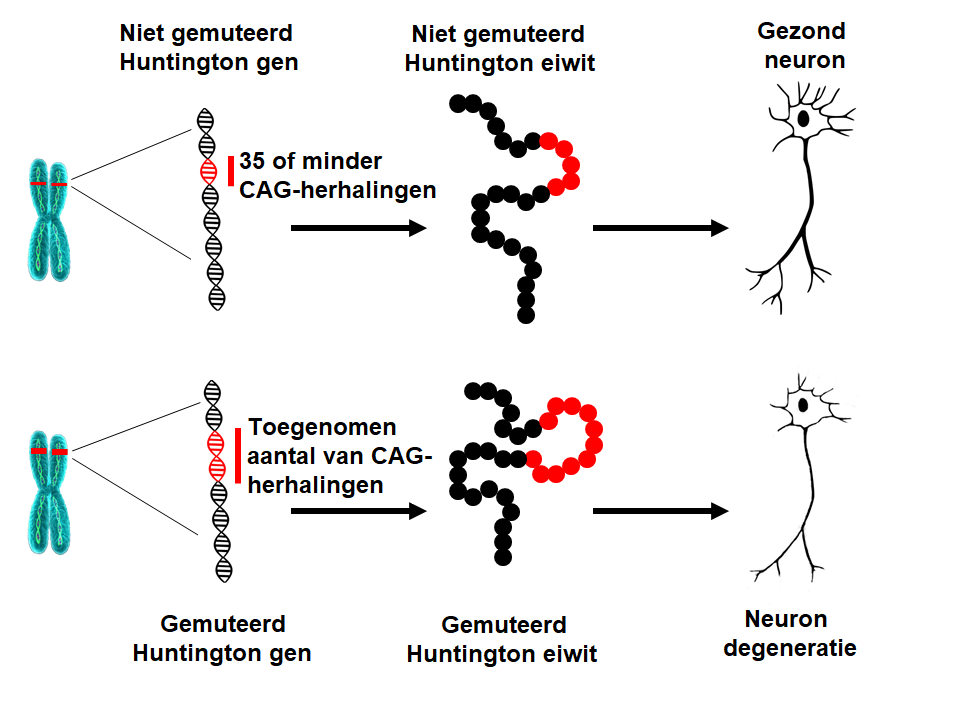
Indien het aantal CAG-herhalingen toeneemt, wordt deze bepaalde reeks van DNA instabieler. Dit betekent dat het aantal herhalingen in deze reeks kan toenemen of afnemen wanneer het wordt doorgegeven aan de volgende generatie. Zolang het aantal CAG-herhalingen in het HTT gen minder is dan 27, is de reeks stabiel. Als het aantal herhalingen tussen de 27 en de 35 (het zogeheten tussenliggende herhaling lengte) zal het individu de ZvH niet ontwikkelen en de reeks wordt dan als normaal beschouwd. Een CAG-herhaling van 27 of meer is echter instabiel en gevoelig voor toename wanneer het wordt doorgegeven aan de volgende generatie, dit betekent dat deze kinderen het risico bij zich dragen om de ZvH te ontwikkelen. Individuen met een aantal CAG-herhalingen tussen de 36 en 39 kunnen de ZvH ontwikkelen, maar enkel erg laat in het leven, als zij het al ontwikkelen. Dit is bekend als de reeks met de verminderde-‘penetrantie’ herhaling lengte (‘penetrantie’ wil zeggen dat als een individu het Huntington-gen in zijn erfelijk materiaal meedraagt hij/zij in principe altijd ziek wordt). Wanneer het aantal CAG-herhalingen meer dan 39 is, zal een persoon de ZvH op een bepaald moment in het leven ontwikkelen – meestal op middelbare leeftijd. In zeldzame gevallen kan de CAG verlenging buitengewoon lang zijn, dit leidt tot het begin van de ziekte tijdens adolescentie of de kinderjaren (juveniele HD). Patiënten die de ziekte ontwikkelen voor het 10de levensjaar hebben meer dan 80 CAG-herhalingen.Wat betekent de lengte van de HTT CAG herhaling?
De lengte van CAG-herhaling
Veroorzaakt het ziekte?
Consequenties voor nakomelingen?
Naam
Onder de 27
Nee
Geen
Normale-herhaling lengte
27-35
Nee
Een herhaling van 27 of meer kan onstabiel zijn en neemt mogelijk toe wanneer dit wordt doorgegeven aan een nakomeling.
tussenliggende-herhaling lengte
36-39
Misschien
Ja, nakomelingen hebben 50% kans op overerving van het uitgebreide gen
Afgenomen 'penetrantie' herhaling lengte
40 en meer
Ja
Ja, nakomelingen hebben 50% kans op overerving van het uitgebreide gen
Volledig 'penetrantie' herhaling lengte
Genen worden gevonden op onze chromosomen in elke lichaamscel. Een gen is een reeks van DNA dat een code bevat voor een bepaald eiwit; het DNA wordt overgeschreven in messenger RNA (mRNA), welke weer wordt vertaald in een eiwit. Meestal erft iedereen twee kopieën van elk gen – een van de moeder en een van de vader. In de ZvH is het belangrijke gen het HTT gen, welke het huntingtine eiwit maakt. Wanneer een kind de verlengde versie van het HTT gen overerft dan zal het kind ook de ZvH ontwikkelen. De ouder zelf kan de ziekte al hebben of dit later op latere leeftijd ontwikkelen.Wat is een gen?
Eiwitten zijn lange moleculen gemaakt van bouwstenen die aminozuren heten. De exacte reeks van aminozuren in een bepaald eiwit wordt bepaald door de DNA reeks van het bijhorende gen. Dit is de reden dat genen als blauwdrukken functioneren – een samenstelling van instructies die cellen vertellen hoe ze een bepaald eiwit moeten bouwen. Het HTT gen bevat instructies hoe het huntingtine eiwit gebouwd moet worden. Eiwitten zijn de moleculen die werken binnen in de cellen – ze voeren een groot aantal essentiële processen uit, zoals enzymreacties of structurele ondersteuning. Als een eiwit abnormaal functioneert of mist als gevolg van een verlenging in het gen dat het eiwit codeert, dan kan het de cel en uiteindelijk het hele organisme aantasten, soms leidt het tot ziekte.Wat is een eiwit (proteïne)?
Het huntingtine eiwit is een erg lang eiwit dat in verschillende mate in elke cel van het menselijk lichaam wordt gemaakt of “tot expressie wordt gebracht”; de grootste hoeveelheid wordt gevonden in de hersenen. Huntingtine lijkt een erg belangrijk eiwit omdat de afwezigheid ervan leidt tot de dood van muisembryo’s. Op een bepaald uiteinde van het huntingtine eiwit is er een stuk herhalingen van een bepaald aminozuur dat glutamine wordt genoemd. Deze kenmerkende eigenschap, bekend als de polyglutamine-herhaling, bestaat normaal gesproken uit maximaal 35 glutamine eenheden. Bij mensen die de Huntington verlenging dragen, bevat deze echter 36 herhalingen en is het deze verlenging van polyglutamine die resulteert in een eiwit dat niet goed functioneert.Het Huntingtine eiwit
De ZvH is een dominante erfelijke ziekte. Dit betekent dat een persoon die geboren is met één kopie van het afwijkende HTT gen de ZvH zal ontwikkelen, ook al draagt hij/zij ook een normale kopie van het gen. Een drager van de ZvH verlening, zowel symptomatisch als asymptomatisch, kan zowel een kopie van het normale als van het afwijkende gen doorgeven met 50% kans (op voorwaarde dat hij/zij alleen de verlenging van één van de twee kopieën van het HTT gen draagt). Medische technieken kunnen ervoor zorgen dat een aangedaan persoon alleen het normale HTT gen doorgeeft aan zijn of haar kinderen. Aan de andere kant, zal een persoon die het afwijkende HTT gen niet geërfd heeft de ziekte niet ontwikkelen en zijn of haar kinderen zullen dus ook geen risico hebben op het erven van het gen en ontwikkelen van de ziekte. De ZvH verlenging kan geen generatie overslaan. Echter kan het zijn dat een gendrager sterft voordat de symptomen zijn ontstaan en dat zijn of haar kinderen niet doorhebben dat zij risico hebben op het ontwikkelen van de ziekte.Hoe wordt de ZvH doorgegeven?
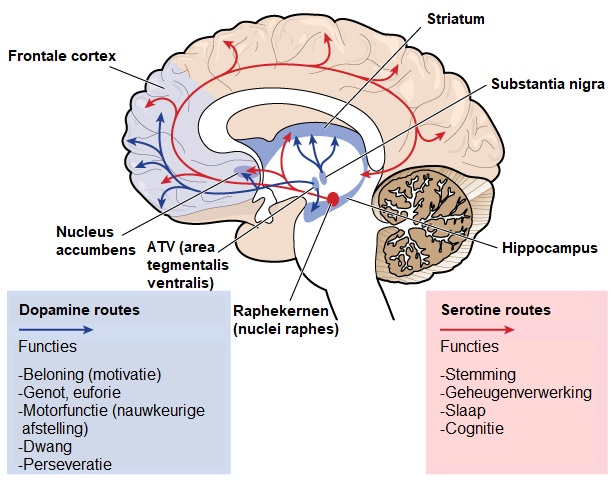
Bepaalde functies van de hersenen, zoals het vermogen om te bewegen, denken en praten, nemen geleidelijk af in de ZvH doordat cruciale zenuwcellen worden beschadigd en afsterven. Het deel van de hersenen dat het meest is aangedaan bij de ZvH is het striatum, dit is een onderdeel van de basale ganglia en ligt diep in de centrale regio van de hersenen. Het striatium is voornamelijk betrokken bij het plannen en controleren van bewegingen, maar ook bij veel andere processen, waaronder cognitie en emoties. Naarmate de ZvH vordert, tast het de cortex aan (het buitenste gerimpelde deel van de hersenen), dit draagt bij aan cognitieve achteruitgang. Over het algemeen veroorzaakt de ZvH in de loop van de tijd atrofie van het hele brein, waardoor een individu wordt beperkt in zijn of haar algemene functionele capaciteit.Betrokken hersengebieden bij ZvH
De ZvH in het dagelijks leven
Een positieve test voor de Huntington verlenging kan invloed hebben op verschillende onderdelen van het leven van een persoon, zoals de beslissing om kinderen te nemen of niet, plannen voor de toekomst, het heroverwegen van prioriteiten, onderhandelen over een geschikte huisvesting en het informeren van andere familieleden dat zij mogelijk ook risico hebben op het krijgen van de ziekte. Vooral jong volwassenen moeten de mogelijke invloed van een positieve test op hun opleiding, training en werk heroverwegen. Naarmate de ziekte voortschrijdt, beïnvloedt het in toenemende mate de mogelijkheid om zelfstandig te leven. Het uitvoeren van werk, het sociale leven en alledaagse activiteiten zullen steeds moeilijker worden en patiënten worden afhankelijker van hulp en steun van familie, vrienden en professionele dienstverlening. Lokale patiëntenverenigingen en klinische centra kunnen op elk moment benaderd worden en zullen steun bieden.Hoe heeft de ZvH invloed op het dagelijks leven?
Manieren om beter om te gaan met de ZvH moeten per persoon bepaald worden en dit hangt af van de aangedane persoon, de fase van de ziekte en de familieomstandigheden. De ZvH ontwikkelt zich erg langzaam, waardoor er over het algemeen genoeg tijd is om zich aan te passen aan veranderingen die de ziekte met zich meebrengt. Het is van belang dat verzorgers en naasten een beter begrip krijgen van de ziektegerelateerde gedragsmatige en mentale beperkingen om zich zo aan te kunnen passen aan deze veranderingen en om een goede relatie te kunnen houden met de persoon die aan de ziekte lijdt. Uw specialist en patiëntenvereniging kunnen u hierover belangrijke informatie en waardevolle adviezen geven.Zijn er strategieën om beter om te gaan met de ZvH?
Als u op deze pagina bent gekomen, vindt u een lijst met taalcoördinatoren (language area coördinators) die u kunnen helpen. U kunt ook het contactformulier gebruiken dat hier wordt verstrekt.Hoe contact ik EHDN?
U kunt een afspraak krijgen via een verwijzing van uw huisarts of door contact op te nemen met uw lokale EHDN-taalcoördinator, die zal u dan verder helpen.Hoe kan ik een afspraak krijgen met een specialist?
Onafhankelijk advies over de ZvH kan worden verkregen bij uw landelijke patiëntenverenigingen.Is er een manier waarop ik een specialist kan spreken zonder naar een
ziekenhuis te gaan?
EHDN speelt een sleutelrol in de wereldwijde klinische studie Enroll-HD. Dit is een observationele studie zonder behandeling. Dit betekent dat er geen experimentele therapieën op zich worden getest. De deelnemers krijgen een klinische evaluatie tijdens hun jaarlijkse afspraken en zij kunnen in aanmerking komen om deel te nemen aan klinische onderzoeken naar symptomatische of ziekte modificerende behandelingen wanneer deze beschikbaar zijn. Enroll-HD is toegankelijk via verschillende deelnemende ZvH studie centra over de wereld. Om te bekijken of er een ziekenhuis bij u in de buurt deelneemt aan dit onderzoek, kijkt uw alstublieft hier of benader uw EHDN-taalcoördinator, die u alles kan vertellen over onderzoek in uw regio. Uw lokale patiëntenverenigingen kunnen u algemene informatie geven over deelname aan wetenschappelijk onderzoek. Voor meer informatie over het Huntington onderzoek, kijkt u alstublieft hier of bezoek de HDBuzz webpagina met nieuws over onderzoek naar Huntington geschreven door Huntington onderzoekers in lekentaal en vertaald in bijna alle talen.Hoe kan ik betrokken raken bij onderzoeken naar de ZvH?
Ja, een aantal patiëntenverenigingen bieden steun aan personen met de ziekte van Huntington en families waarin de ziekte voorkomt. Deze organisaties kunnen bereikt worden via uw huisarts, uw ZvH specialist of u kunt rechtstreeks contact opnemen met ze. De European Huntington’s disease Association (EHA) houdt een lijst met patiëntenverenigingen bij die mogelijk nuttig voor u kunnen zijn.Zijn er steungroepen die gespecialiseerd zijn in de ZvH?
Voor al uw andere vragen, neem alstublieft contact op met uw EHDN- taalcoördinator of uw lokale patiëntenvereniging.

